Fallbericht März 2020:
Paraneoplastische Alopezie infolge eines metastasierenden Pankreaskarzinoms bei einem elfjährigen Kater
Paraneoplastische Syndrome können sich bei Hunden und Katzen in einer Vielzahl von hämatologischen und blutchemischen Veränderungen aber auch in unterschiedlichen klinischen Symptomen äußern (Schwandt-Müller, 2013). Sie werden in vielen Fällen durch tumorspezifische Produkte ausgelöst, die an einer anderen Lokalisation im Körper eine Sekundärreaktion auslösen. Somit stehen sie nicht direkt im Zusammenhang mit dem Wachstum des Primärtumors bzw. den metastatischen Zellgruppen eines Tumors (Schwandt-Müller, 2013).
Die paraneoplastische Alopezie ist ein seltenes Syndrom, das bei Katzen im Zusammenhang mit verschiedenen soliden Tumoren auftritt (Pascal-Tenorio et al., 1997, Barrs et al., 1999). Sie sollte differentialdiagnostisch bei älteren Katzen, die eine Alopezie und ggf. Juckreiz entwickeln, berücksichtigt werden. Im vorliegenden Bericht wird der Fall einer Katze mit paraneoplastischer Alopezie im Zusammenhang mit einem metastasierenden Pankreaskarzinom beschrieben.
Anamnese
Vorgestellt wurde ein 11 Jahre alter, männlich kastrierter Europäisch Kurzhaar Kater, der seit drei Monaten wegen Alopezie und Juckreiz in tierärztlicher Behandlung war. Der Kater lebte im Haus mit zwei weiteren Katzen, die beide gesund waren. Das Allgemeinbefinden schien zunächst ungestört. Beim Haustierarzt erfolgte eine antimykotische Therapie mit Itrakonazol (Itrafungol, Fa Lilly, 1xtgl 0,5mg/kg) oral für 3 Wochen und eine einmalige Flohtherapie mit Fipronil (Frontline Spot on Katze, Fa Boehringer Ingelheim GmbH). Eine blutchemische Untersuchung (IDEXX Catalyst One, IDEXX Ludwigsburg), eine hämatologische Untersuchung (VetAutoread, IDEXX), eine Gesamt-T4 Bestimmung (Laboklin, Bad Kissingen, Referenzbereich: 1,5-4,7 µg/dl), eine serologische FeLV- (ELISA, Laboklin, Bad Kissingen), FIV- (Antikörper,Laboklin, Bad Kissingen) und FIP-Untersuchung (IFAT, Laboklin, Bad Kissingen) sowie eine mykologische Untersuchung (mikroskopisch und kulturell, Laboklin, Bad Kissingen) wurden vom vorbehandelnden Tierarzt eingeleitet. Die chemische Blutuntersuchung wies mit Ausnahme eines geringgradig erniedrigten Harnstoffgehaltes (4,4mmol/l, Referenzbereich 5,7-12,9 mmol/l) keine Auffälligkeiten auf. Alle übrigen Untersuchungen, einschließlich der mykologischen Untersuchung waren ohne Befund. Das Tier wurde daraufhin vom Haustierarzt schrittweise mit Prednisolon oral (Präparat nicht bekannt), Oclacitinib (Apoquel 3,4mg, Fa Zoetis) und Cefovecin (Convenia Injektionslösung 80mg/ml, Fa Zoetis) behandelt, ohne dass eine deutliche Verbesserung auftrat. Die Dauer und Dosierung der Therapie war nicht bekannt. Aufgrund der persistierenden Hautsymptomatik und des zunehmend gestörten Allgemeinbefindens wurde der Kater überwiesen und am 5.06.2018 in der Hautsprechstunde vorgestellt.
Klinische Befunde
Bei Vorstellung in der Sprechstunde präsentierte sich der Kater mit reduziertem Allgemeinbefinden. Der Ernährungszustand war mäßig (Körpergewicht 3,1kg). Die kapilläre Füllungszeit war normal und die Körpertemperatur betrug 38,2°C. Alle tastbaren Lymphknoten waren ohne Befund. Das Abdomen war bei Palpation leicht angespannt. Die Auskultation von Herz und Lunge waren unauffällig.
Bei der dermatologischen Untersuchung war eine Alopezie am ventralen Abdominal-, Thorakal-, Halsbereich, Nacken, Kopf- und Gesichtsbereich sowie an den Außenseiten der Pinnae sichtbar (Abb. 1 und 2). Zudem trat eine Haarlosigkeit an den medialen Gliedmaßen und Pfoten auf. Im dorsalen Pfoten- und Krallenbettbereich zeigten sich dunkle, teils schmierige, teils eingetrocknete dunkelbraune Beläge (Abb. 4). Am Bauch und ventralen Hals war die Haut pergamentpapierartig und leicht glänzend, stellenweise erythematös (Abb.2). Die Ballenhaut war sehr dünn und erythematös. Die Pinnae erschienen alopezisch, glänzend und geringgradig schuppig (Abb.3). Die Haare im Randbereich der Alopezie waren sehr leicht epilierbar. Im Rückenbereich erschien das Fell stumpf mit kleinen trockenen Schuppen.
Die Gehörgänge waren beidseits trocken, nicht entzündlich und ohne Fremdmaterial. Das Trommelfell war beidseits intakt.
Differentialdiagnosen
Bilateral symmetrischen Alopezien bei Katzen können verschiedene Ursachen zu Grunde liegen. Eine selbstinduzierte Alopezie durch übermäßige Fellpflege wird durch Juckreiz aufgrund von Ektoparasitosen, Allergien oder Dermatophytosen, aber auch durch eine psychogene Verhaltensstörung hervorgerufen, die das Tier zu einem stereotypen Verhaltensmuster zwingt. Symmetrische Alopezien, die ohne Juckreiz einhergehen, können durch Endokrinopathien wie Hyperthyreose oder Hyperadrenocortizismus verursacht werden. Auch telogenes Effluvium, Alopecia areata, Pseudopelade und die murale lymphozytäre Follikulitis sind differentialdiagnostisch bei bilateralen Alopezien zu berücksichtigen (Turek 2003, Sharp et al., 2014). Grundsätzlich können sekundäre kutane Infektionen mit Bakterien oder Hefepilzen aufgrund einer primären systemischen Erkrankung oder Hauterkrankung sekundär einen Juckreiz induzieren und somit traumatischen Haarverlust verursachen. Als wichtigste Differentialdiagnose zu einer paraneoplastischen Alopezie wird der Hyperadrenokortizismus beschrieben (Gross et al., 2005).
Weitere diagnostische Verfahren
Zur weiteren Aufarbeitung der Alopezie und des Juckreizes wurden verschiedene dermatologische Untersuchungsverfahren zum Ausschluss bzw. Nachweis einer Infektion durchgeführt. Aufgrund der systemischen Krankheitsanzeichen wie Inappetenz und reduziertem Allgemeinbefinden wurde im Anschluss eine Ultraschalluntersuchung des Abdomens geplant.
Da durch Besitzerangaben der Juckreiz und die Alopezie im Vordergrund stand, wurde zunächst das Fell mit einem Flohkamm ausgekämmt und auf Flöhe und Flohkot untersucht. Die Untersuchung verlief negativ. Zur Untersuchung auf Cheyletiella blakei wurde ein Tesafilmstreifen (Tesa Film, cristal clear, 10x19mm) großflächig auf die kleinen Schuppen im Fell des Rückenbereiches gepresst und nativ bei 4 und 10 -facher Vergrößerung mit einem Mikroskop (Olympus BX 43, Firma Olympus D GmbH, Hamburg) untersucht. Die Untersuchung wurde negativ befundet. Ein oberflächliches Hautgeschabsel von Rücken und Bauch ergab keinen Nachweis oberflächlich lokalisierter Milben wie Demodex gatoi oder Notoedres cati.
Bei der dermatologischen Untersuchung fiel auf, dass die Haare leicht epilierbar waren, was für eine rein traumatische Leckalopezie eher unwahrscheinlich ist. Aufgrund der Vorbehandlung mit Kortison und Verdacht auf eine systemische, immunsupprimierte Erkrankung wurde eine Infestation des Haarbalges mit Demodex cati mittels der Durchführung eines tiefen Hautgeschabsels ausgeschlossen. Eine Dermatophytose, die ebenfalls zu einer Infestation des Haarfollikels führt, wurde beim Haustierarzt 3 Wochen zuvor durch eine negative mykologische Kultur ausgeschlossen.
Zur Beurteilung der Haarwurzeln, -spitzen und -schäfte wurde eine Trichoskopie durchgeführt. Dazu wurden Haare im Pfoten-, Kopf- und Rückenbereich entnommen. Die ausgezupften Haare hatten eine glatte Oberfläche, telogene Haarwurzeln und im Bereich der Pfoten abgebrochene Haarspitzen. Die Haarspitzen von Kopf und Rücken erschienen intakt.
Die abgebrochenen Haarspitzen der Pfoten verdeutlichten einen vermehrten Putzdrang in dieser Lokalisation. Klinisch zeigten sich im Pfotenbereich dunkle, wachsartige Beläge. Ein Tesafilmabklatschpräparat wurde von Pfoten und Krallenbett entnommen, mit Methylenblau der DiffQuick-HAEMA Schnellfärbung (Labor und Technik, Eberhard Lehmann GmbH) angefärbt und mikroskopisch bei 10, 40 und 100 - facher Vergrößerung untersucht. In den untersuchten Präparaten ließen sich vereinzelt Epithelzellen, Kokken (1-2/HPF) und Malassezien (7-10/HPF) darstellen.
Die dermatologischen Untersuchungen ergaben keine Hinweise auf eine parasitäre Infektion. Im Pfoten- und distalen Gliedmaßenbereich wurde die Diagnose Malasseziendermatitis gestellt (Referenzwert 1-2 Malassezien/HPF, Noli et al., 2014a, Miller et al., 2013a).
Aufgrund des reduzierten Allgemeinbefindens und der Inappetenz wurde der Verdacht auf eine paraneoplastische Alopezie weiter aufgearbeitet und eine abdominale Sonographie durchgeführt. In diesem Rahmen sollte auch die Nebennierengröße ermittelt werden, um in Ergänzung zu den unauffälligen klinisch-chemischen Parametern einen Hyperadrenokortizismus weiter ausgrenzen zu können.
Die sonographische Untersuchung mit einem Ultraschallgerät der Firma GE Logic (9-12 MHz linearer Schallkopf) wurde in Rückenlage durchgeführt. Dazu wurde der Bauch des Tieres geschoren.
Es wurden folgende Befunde erhoben:
Die Harnblase war ohne strukturelle Veränderungen. Die Nieren und Nebennieren erschienen sonographisch unauffällig. Die Milz war geringgradig verbreitert und wies eine geringgradig diffus-inhomogene Textur auf. Die Leber war diffus vergrößert. Das Parenchym wies in verschiedenen Lokalisationen hyper- und hypoechogene Herdveränderungen auf (Abb.5). Die Gallenblase und Gallengänge waren unauffällig. Der Magen war ohne Auffälligkeiten. Das Duodenum war leicht verbreitert (Wanddurchmesser 3,2-3,5 mm, Referenzwert <2.8mm). Auffällig war zudem eine geringgradige Verbreiterung der Serosa. Das Pankreas erschien im Corpus stark vergrößert. Es wurden mehrere makronodäre hypoechogene Texturveränderungen festgestellt (Abb.6). Das Peritoneum war diffus hyperechogen und erschien in verschiedenen Lokalisationen verbreitert. Es konnte eine geringe Menge an freier Flüssigkeit festgestellt werden.
Zur weiteren Abklärung der sonographischen Veränderungen wurde unter sonogaphischer Kontrolle eine Feinnadelbiopsie (24-G-Kanüle, Braun) von Pankreas und Leber durchgeführt.
Die zytologische Untersuchung (Färbung mit Diff-Quick) ergab folgenden Befunde:
Punktate des Pankreas: Es waren epithelial-glanduläre Zellverbände mit mittelgradiger Kernatypie sowie diversen Malignitätskriterien feststellbar. Anzeichen einer Entzündung lagen nicht vor. Die zytologische Diagnose lautete Pankreasadenokarzinom (Abb.7)
Punktate der Leber: In den Punktaten der Leber waren Leberepithelverbände mit geringgradigen vakuolären zytoplasmatischen Veränderungen erkennbar. Daneben tauchte wiederholt eine metastatische epithelial-glanduläre Zellpopulation mit mittelgradigen Malignitätskriterien auf (Abb.8) Es war ein Zusammenhang mit der Primärtumorpopulation im Pankreas erkennbar.
Auf eine histopathologische Untersuchung der Haut wurde aufgrund des schlechten Allgemeinzustandes bei diesem Tier verzichtet. Eine Biopsieentnahme in Narkose oder Sedation war aufgrund des schlechten Allgemeinbefindens der Katze nicht gerechtfertigt.
Diagnose
Ursächlich für diese bilateral symmetrische Alopezie im Bauch-, Gliedmaßen- und Kopfbereich mit sekundärer Malasseziendermatitis ist ein metastasierendes Pankreaskarzinom mit Sekundärmetastasierung in die Leber. Die Diagnose wurde hier anhand der klinischen Symptomatik, der glänzenden Hautbeschaffenheit, des Ultraschallbefundes und der zytologischen Untersuchung von Feinnadelbiopsien von Pankreas und Leber gestellt.
Therapie
Die Besitzer wurden über die infauste Prognose der Erkrankung aufgeklärt. Eine Euthanasie kam zu diesem Zeitpunkt für die Besitzer noch nicht in Frage. Die Katze wurde palliativ mit Prednisolon 1mg/kg 1xtgl oral (Prednitab vet. 5mg, cp Pharma) sowie analgetisch mit Metamizol 20mg/kg 3xtgl oral (NovalginTropfen zum Einnehmen, Metamizol 500mg/ml, Sanofi-Aventis Deutschland GmbH) therapiert. Zur Reduktion der Malassezieninfektion und des Juckreizes wurde eine Shampootherapie 2x/ Woche (Malaseb, Chlorhexidin 20mg/Miconazol 20mg/ml, Firma Dechra) empfohlen.
Verlauf und Ergebnisse
Die Katze wurde 2 Wochen später wieder vorstellig in der Praxis. Die Besitzer berichteten, dass zunächst eine geringgradige Verbesserung feststellbar war. Der Appetit war für einige Tage deutlich gesteigert. Auch der Juckreiz hatte sich im Anschluss an die Badetherapie deutlich reduziert. In den letzten Tagen wurde sie jedoch erneut zunehmend inappetent und nahm kaum noch ihre Umgebung wahr.
Die Katze zeigte sich in einem sehr schlechten, kachektischen Zustand. Die Haut war weniger erythematös, die dunklen Beläge im Pfotenbereich reduziert, die Haut weiterhin glänzend, dünn, aber nicht fragil.
Die Katze wurde aufgrund der infausten Prognose mit Pentobarbital 1ml/kg i.v. (Narcoren Injektionslösung, 16g/100ml, Boehringer Ingelheim) euthanasiert.
Diskussion
Die feline paraneoplastische Alopezie ist eine seltene nicht juckende, progressive symmetrische Alopezie, die bei älteren Katzen in Zusammenhang mit einem Pankreaskarzinom (Brooks et al., 1994, Pascal-Tenorio et al., 1997), Gallengangskarzinom (Pascal-Tenorio et al., 1997, Barrs et al., 1999), hepatozellulären Karzinom (Marconato et al., 2007), neuroendokrinem Pankreaskarzinom, extramedullärem Plasmozytom (Caporali et al., 2016) oder Colonkarzinom (Grandt et al., 2015) auftritt.
Klinisch entwickelt sich eine progressiv fortschreitende Alopezie über einen Zeitraum von 2 Wochen bis 10 Monaten. Die Alopezie setzt akut ein und betrifft den ventralen Abdominal- und Thorakalbereich, die medialen Gliedmaßen sowie das Perineum. Die Pinnae und der Oberkopf sind in der Regel ausgespart oder erst im späten Stadium betroffen. Die Ballen sind bei dieser Erkrankung häufig mitbetroffen, erscheinen trocken, rissig und schmerzhaft. Das Auftreten von schwärzlich, wachsartigem Material im Pfotenbereich ist typisch für eine Malasseziendermatitis. Die Haare sind leicht epilierbar, die Haut ist dünn und glänzend, aber nicht fragil (Miller et al., 2013c).
Entsprechende Hautveränderungen wurden auch bei unserem Patienten beobachtet. Die glänzende Hautbeschaffenheit wird auf den Verlust des Stratum corneums zurückgeführt, welche auf das gesteigerte Putzverhalten, oft aufgrund von assoziierten Malassezien- und Flohinfektionen (Godfrey 1998), aber auch durch direkte Wirkung von Tumorsekretionsprodukten zurückzuführen ist (Pascal-Tenorio et al., 1997, Barrs et al., 1999).
Auch wenn Malassezieninfektionen bei Katzen sekundär bei allergischen Erkrankungen auftreten können, werden sie häufiger bei ernsten internistischen Erkrankungen, die eine Immunsuppression auslösen, wie zum Beispiel Neoplasien beobachtet (Mauldin et al., 2002).
Der progressive Verlauf über einen Zeitraum von 3 Monaten mit zunehmender Alopezie und Anzeichen einer systemischen Erkrankung bei dieser Katze stimmt mit den in der Literatur beschriebenen Fällen überein (Miller et al., 2013c). Es ist davon auszugehen, dass die Progression der Hautveränderungen von der Aggressivität der neoplastischen Grunderkrankung abhängt, die im vorliegenden Fall aufgrund der starken Metastasierungsneigung vermutlich sehr hoch war.
Die in der Literatur angegebene Altersprädisposition von alten bis mittelalten Tieren (Miller et al., 2013c) liegt auch in unserem Fall vor und hängt primär von der zugrundeliegenden Tumorart ab.
Die Blutuntersuchung beim Haustierarzt war bis auf einen leicht reduzierten Harnstoffwert, der vermutlich Folge der Inappetenz war, ohne auffällige Befunde, welches sich mit früher beschriebenen Krankheitsfällen deckt (Forsythe 2015).
Da vorberichtlich das gesteigerte Putzverhalten und die Alopezie im Vordergrund standen, wurden alle mit Juckreiz einhergehende Erkrankungen in Betracht gezogen. Parasitäre Ursachen wurden durch weiterführende Untersuchungen ausgeschlossen. Eine Malasseziendermatitis an Pfoten und Gliedmaßen erklärt den sekundären Juckreiz des Tieres. Eine sekundäre Alopezie aufgrund einer Allergie als Ursache wurde ausgeschlossen, da die Katze primär einen Haarverlust zeigte und der Juckreiz zunächst sekundär im Laufe der Erkrankung entstand. Die systemischen Krankheitsanzeichen würden zudem bei einer Allergie nicht auftreten. Telogenes Effluvium, welches bei sehr starkem Stress und physischer Belastung zum plötzlichen Haarausfall führt, ist aufgrund der Diagnose und des Krankheitsverlaufes ausgeschlossen.
Eine Alopecia areata oder Pseudopelade ist eine Autoimmunerkrankung gegenüber dem Haarfollikel und kann histopathologisch diagnostiziert werden. Klinisch zeigen sich eher scharf umschriebene alopezische Bezirke, selten können auch bilateral symmetrische Alopezien auftreten, die klinisch aber nicht entzündlich sind. Die Tiere zeigen zudem keine systemischen Krankheitszeichen (Miller et al., 2013b)
Eine der wichtigsten Differentialdiagnosen ist das Cushing-Syndrom der Katze. Klinisch zeigt sich die Haut bei diesen Patienten im Unterschied zu Patienten mit paraneoplastischer Alopezie häufig sehr fragil. 85% der Katzen mit Hyperadrenokortizismus weisen sonographische Veränderungen einer oder beider Nebennieren auf, was im vorliegenden Fall nicht zu beobachten war. Darüber hinaus zeigen zahlreiche Katzen Leberenzymerhöhungen und einen Diabetes mellitus, was bei unserer Katze ebenfalls nicht feststellbar war, so dass das Vorliegen eines Hyperadrenokortizismus als sehr unwahrscheinlich gilt (Feldman et al., 2004).
Eine lymphozytäre murale Follikulitis repräsentiert ein histopathologisches Entzündungsmuster der Katze, das bei verschiedenen entzündlichen Hauterkrankungen wie Allergien, aber z.B. auch einer Dermatophytose, Sebadentitis, Arzneimittelreaktionen oder Demodikose vorliegen kann. Auch nicht kutane Pathologien können mit einer muralen Follikulitis assoziiert sein (Noli et al., 2014b). Die Therapie hängt von der zugrundeliegenden Erkrankung ab. Bei einem felinen Pankreaskarzinom wurde dieses Entzündungsmuster histopathologisch nur in einem Fall als Übergangsstadium vermutet. (Lobetti, 2014).
Um die Diagnose paraneoplastische Dermatose stellen zu können, sollten theoretisch zwei Kriterien erfüllt sein (McLean 1993): Die Dermatose sollte sich nach der Tumorentstehung entwickelt haben und die Entfernung des Tumors zu einer Regression der Dermatose führen. Diese Kriterien lassen sich aufgrund des fortgeschrittenen Tumorstadiums in vielen Fällen nicht reproduzieren.
Bei dieser Katze sind beide Kriterien nicht eindeutig nachweisbar, da ein Pankreaskarzinom diagnostiziert wurde, als die Hautsymptome weit fortgeschritten waren. Ein mögliches Ansprechen der Dermatose auf die chirurgische Tumorentfernung konnte in diesem Fall nicht bewiesen werden. Trotzdem kann die Diagnose paraneoplastische Alopezie gestellt werden, da der Nachweis des metastasierenden Pankreaskarzinoms in Kombination mit der Lokalisation der Alopezie, die dünne und glänzende Hautbeschaffenheit, Ausschluss der Differentialdiagnosen, sowie der Verlauf vergleichbarer in der Literatur beschriebener Fälle für die Diagnosestellung ausreichend sind (Marconato et al., 2007).
Insbesondere in Anfangsstadien von Tumorerkrankungen oder bei nicht aussagekräftiger Abdominalsonographie, kann eine histopathologische Untersuchung der Haut entscheidende Hinweise auf das Vorliegen eines Tumors geben. Es liegt eine charakteristische Telogenisierung der Haarfollikel, follikuläre Miniaturisierung und Atrophie vor. Weniger spezifische Befunde können eine milde epidermale Akanthose und Hyperplasie sowie ein dünnes oder nicht vorhandenes Stratum corneum sein. Auch eine milde Parakeratose mit mononukleärem perivaskulärem Entzündungsinfiltrat wird beschrieben (Brooks et al., 1994, Pascal-Tenorio et al., 1997, Mauldin et al., 2002).
Die Prognose bei einem Pankreaskarzinom ist in der Regel infaust. In über 80 % der Fälle (Andrews 1987) ist es wie bei unserem Patienten bei der Diagnosestellung bereits zur Metastasierung gekommen. Ist dies nicht der Fall, kann eine partielle Pankreatektomie versucht werden. Eine adjuvante Chemotherapie ist meist nicht erfolgreich. Ein Nachwachsen der kompletten Haare im Anschluss an ein erfolgreiches chirurgisches Vorgehen wird zwar in einem Fall einer paraneoplastischen Alopezie beschrieben, aber auch ein auftretendes Rezidiv aufgrund von Metastasen bzw Mikrometastasen zum Zeitpunkt der OP (Tasker et al., 1999).
In der Kleintierpraxis werden häufig Katzen mit Juckreiz und Alopezie vorgestellt, wobei am häufigsten die Diagnose Allergie oder parasitäre Infektion gestellt wird. Der vorliegende Fall zeigt, dass bei einem älteren Tier mit systemischen Krankheitsanzeichen und Hautsymptomen trotz normaler Blutwerte eine paraneoplastische Erkrankung frühzeitig in Betracht gezogen werden sollte, da die Hautsymptome klinisch vor der Tumordiagnose in Erscheinung treten können und somit eine verbesserte Prognose zur Folge haben kann (Schwandt-Müller , 2013).

Abb. 1: Klinische Präsentation der Katze bei Erstvorstellung mit Alopezie periorbital
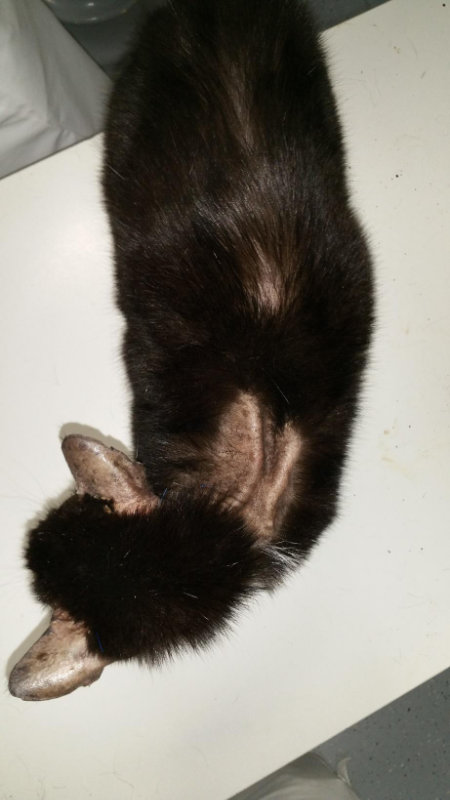
Abb. 3: glänzende, schimmernde Haut im Pinnabereich.
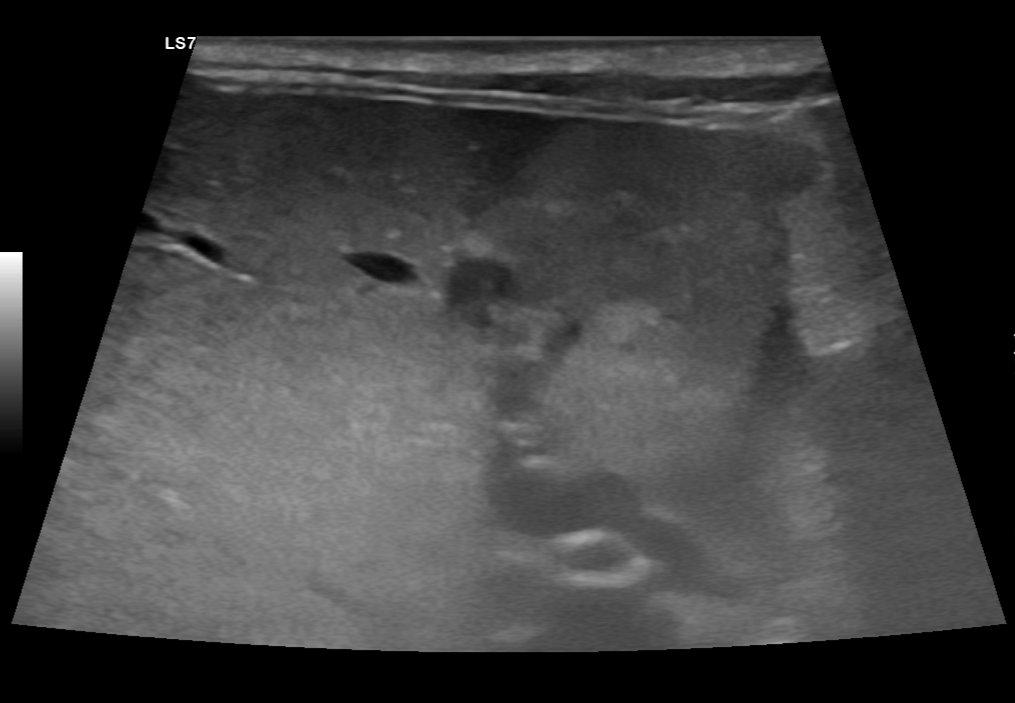
Abb. 5: Ultraschallbild der Leber im Längsschnitt. In diesem Areal sind mehrere hypo- und hyperechogene makronoduläre Veränderungen erkennbar. Zudem sind in der Leberumgebung Anzeichen einer Peritonitis vorhanden.
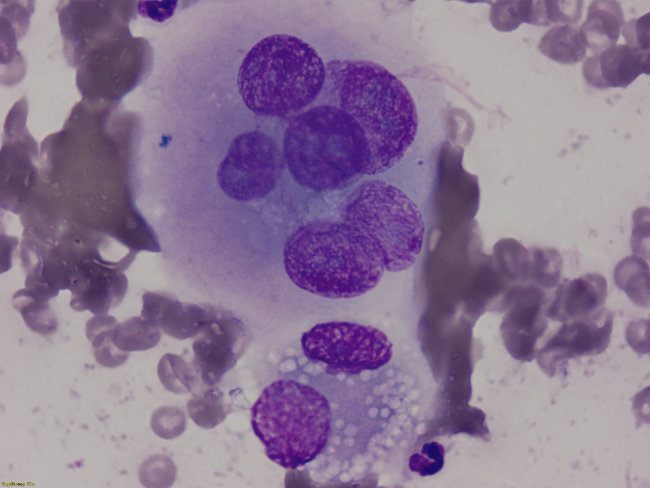
Abb. 7: Feinnadelbioptat des Pankreas. Bild eines Pankreasadenokarzinoms. Es zeigt sich im oberen Bildausschnitt ein epithelialer Zellverband mit Anisokaryose, verklumpten Chromatinstrukturen, diversen Makronukleoli und einem Crowdingphänomen. Im unteren Bildabschnitt ist eine normale vakuolisierte Pankreaszelle erkennbar (DiffQuick, 1000x Vergrößerung).
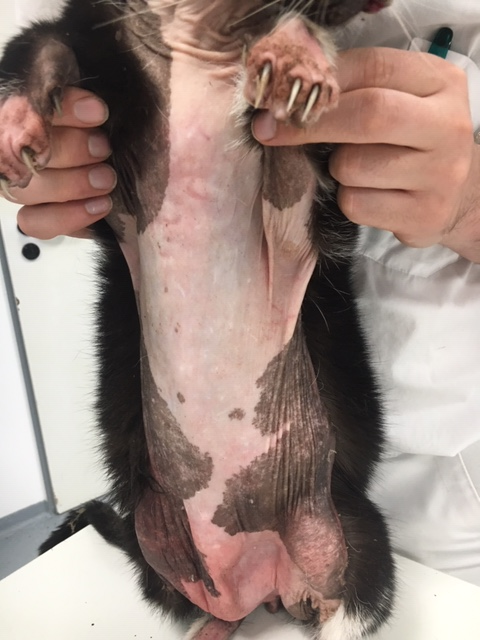
Abb. 2: dünne, schimmernde, leicht glänzende Haut am ventralen Abdomen und Thorax
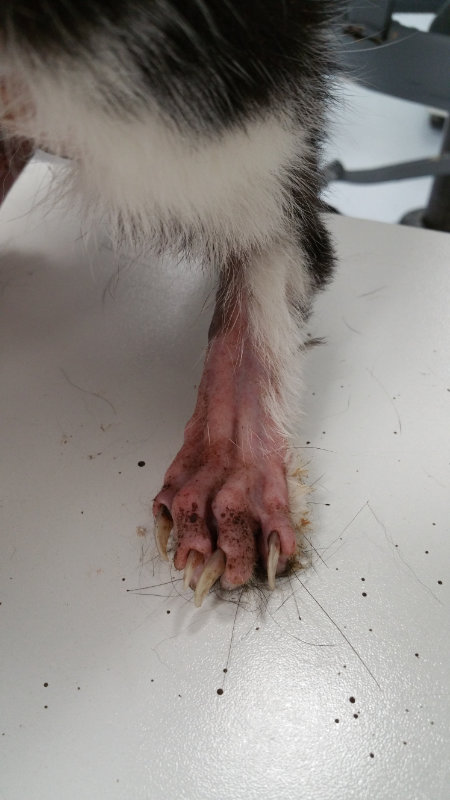
Abb. 4: wachsartige, dunkle Beläge im Pfoten- und Krallenbett bei einer Malasseziendermatitis
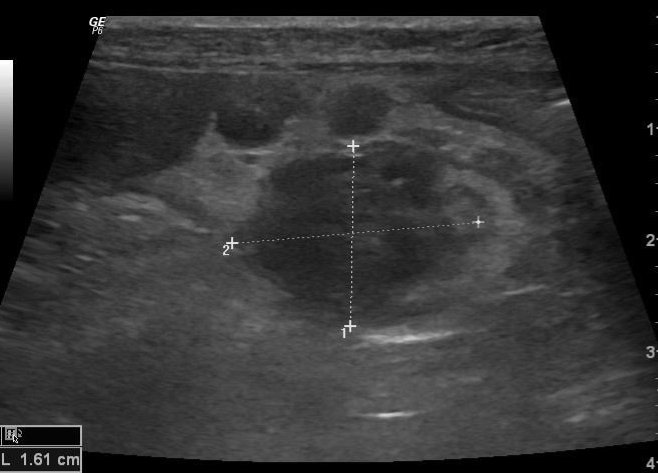
Abb. 6: Ultraschallbild des Pankreaskörpers im Längsschnitt. Es sind mehrere hypoechogene makronoduläre Veränderungen erkennbar.
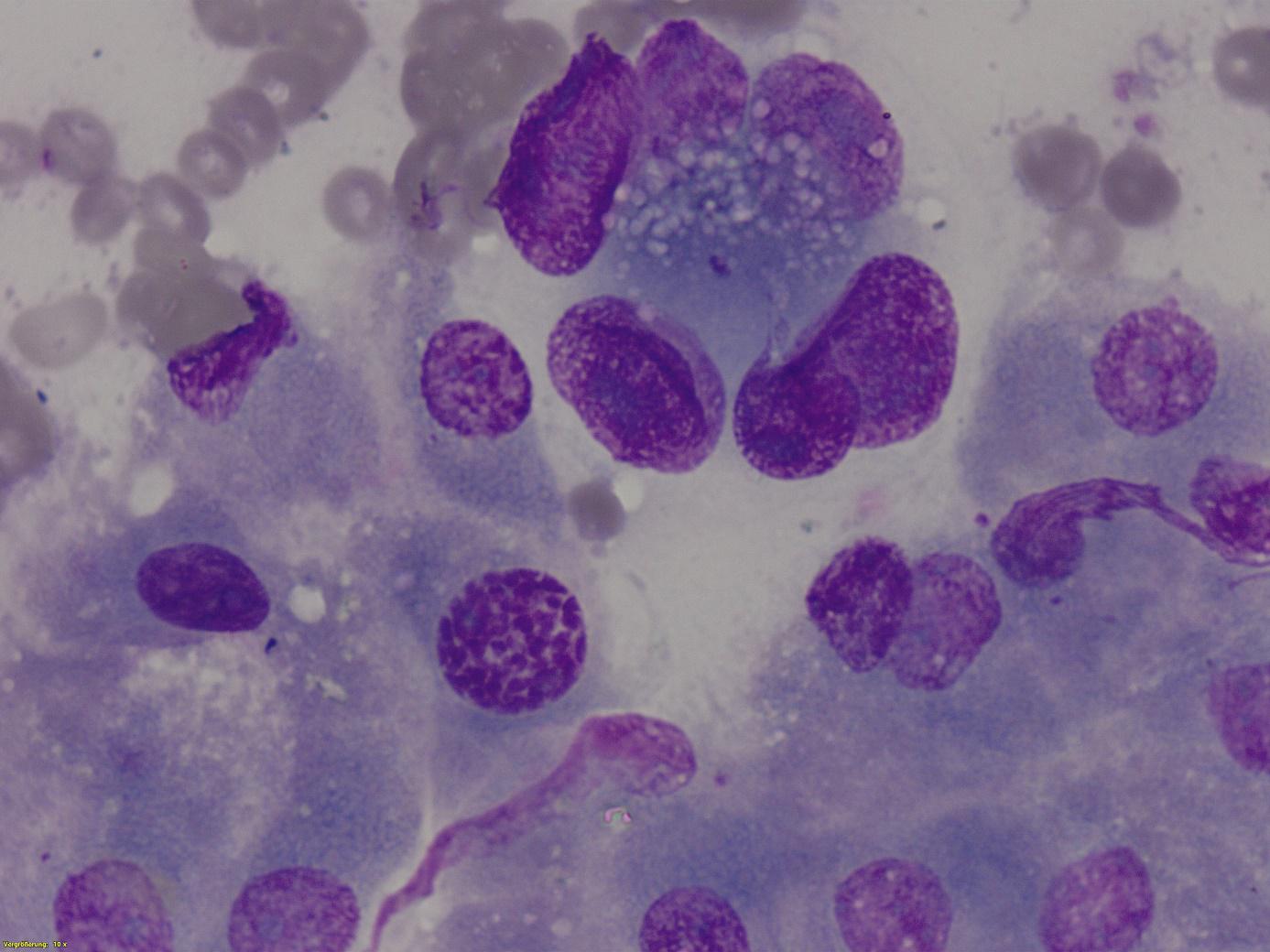
Abb. 8: Feinnadelbioptat der Leber. Zytologisches Bild einer Pankreaskarzinommetastase in der Leber. In der unteren Bildhälfte sind normale Leberepithelzellverbände erkennbar. Im oberen Abschnitt ist ein epithelial-glandulärer Zellverband mit deutlicher Anisokaryose, Anisonukleose, Chromatinverdickung und Kernmembranverdickung erkennbar. Der Zellverband entspricht morphologisch dem Pankreasprimärtumor (DiffQuick, 1000x Vergrößerung).
Literaturverzeichnis
Andrews, L. K. (1986) Tumours oft the exocrine pancreas. In: Diseases of the cat. Medicine and Surgery (J. Holzworth: editor) W. B. Saunders, Philadelphia, S. 505-507.
Barrs, V.R., Martin, P., France, M., Mason, K. (1999) What is your diagnosis? Journal of Small Animal Practice 40, S. 594-596.
Brooks, D.G., Campbell, K.L., Dennis, J.S, Dunstan, R.W. (1994) Pancreatic paraneoplastic alopecia in three cats. Journal of the American Animal Hospital Association 30, S. 557-563.
Caporali, C., Albanese, F., Binanti, D., Abramo, F. (2016) Two cases of feline paraneoplastic alopecia associated with a neuroendocrine pancreatic neoplasia and a hepatosplenic plasma cell tumour. Veterinary Dermatology, 27, S. 508-e137
Feldman, E.C., Nelson R.W. (2004), Hyperadrenocorticism in cats (Cushing`s Syndrome), Chapter 7, In: Canine and Feline Endocrinology and Reproduction (Feldman, E.C., Nelson R.W.: Editors) 3th Edition, Saunders, S. 358-393.
Forsythe, P. (2015) Feline Paraneoplastic Skin Diseases. 40th World small animal veterinary association congress, Bangkok, Thailand 15-18. May 2015, Proceedings book 2015 pp.673-675.
Godfrey D.R. (1998) A case of feline paraneoplastic alopecia with secondary Malassezia-associated dermatitis. Journal of Small Animal Practice 39, S. 394-396
Grandt, L.M., Roethig, A., Schroeder, S., Koehler, K., Langenstein, J., Thom, N., Neiger, R. (2015) Feline paraneoplastic alopecia associated with metastasising intestinal carcinoma. Journal of Feline Medicine and Surgery Open Reports 1, S. 1-5
Gross, T.L., Ihrke, P.J., Walder, E.J. (2005) Feline paraneoplastic alopecia. In: Skin diesease of the dog and cat (Gross T.L., Ihrke P.J., Walder E.J.: Editors), 2. Auflage, Iowa, S. 498-501.
Lobetti, R. (2014) Lymphocytic mural folliculitis and pancreatic carcinoma in a cat. Journal of Feline Medicine and Surgery, Vol.17, 6, S. 548-550
Marconato, L., Albanese, F., Viacava, P., Marchetti, V., Abramo, F. (2007) Paraneoplastic alopecia associated with hepatocellular carcinoma in a cat. Veterinary Dermatology 18, S. 267-271
Mauldin, E.A., Morris, D.O., Goldschmidt, M.H. (2002) Retrospective study. The presence of Malassezia in feline skin biopsies. A clinicopathological study. Veterinary Dermatology 13, S. 7-13.
McLean, D.I. (1993) Toward a definition of cutaneous paraneoplastic syndrome. Clinics in Dermatology 11, S.11-13.
Miller, W., Griffin, C., Campbell, K. (2013a), Diagnostic Methods. In: Muller & Kirk`s Small Animal Dermatology (Miller, W.H., Griffin, C. E., Campbell, K. L.: Editors), 7th Edition, Elsevier, 2, S. 57-107.
Miller, W., Griffin, C., Campbell, K. (2013b), Autoimmune and Immune-Mediated Dermatoses. In: Muller & Kirk`s Small Animal Dermatology (Miller, W.H., Griffin, C. E., Campbell, K. L.: Editors), 7th Edition, Elsevier, 9, S. 432-500.
Miller, W.H., Griffin, C. E., Campbell, K.L. (2013c), Neoplastic and Non-Neoplastic Tumors. In: Muller & Kirk`s Small Animal Dermatology 7th Edition (Miller, W.H., Griffin, C. E., Campbell, K. L.: Editors), Elsevier, 20, S. 774-843.
Noli, C., Scarampella, F., Toma, S. (2014 a) Pilzerkrankungen. In: Praktische Dermatologie bei Hund und Katze (C. Noli, F. Sarampella, Toma.S: Hrsg), 3. Auflage, Hannover, Schlütersche Verlag, 31, S. 247-261.
Noli, C., Scarampella, F., Toma, S. (2014 b) Immunmediierte Erkrankungen. In: Praktische Dermatologie bei Hund und Katze (C. Noli, F. Sarampella, Toma.S: Hrsg), 3. Auflage, Hannover, Schlütersche Verlag, 36, S. 325-360.
Pascal- Tenorio, A., Olivry, T., Gross, T.L., Atlee, B.A., Ihrke, P.J. (1997) Paraneoplastic alopecia associated with internal malignancies in the cat. Veterinary Dermatology 8, S. 47-52.
Schwandt-Müller, F. (2013) Paraneoplastische Syndrome. In: Kleintieronkologie Diagnose und Therapie von Tumorerkrankungen bei Hund und Katze (Kessler, M.: Hrsg) 3. Auflage, Stuttgart, Enke-Verlag, 4, S. 23-32
Sharp, S.J., Meadows, R.L., Senter, D.A., Kuroki, K. (2014) Pathology in Practice. Journal of the American Veterinary Medical Association, Vol.244, 11, S. 1265-1267
Tasker, S., Griffon, D.J., Nuttall, T.J., Hill, P.B. (1999) Resolution of paraneoplastic alopecia following surgical removal of a pancreatic carcinoma in a cat. Journal of Small Animal Practice 40, S. 16-19
Turek, M.M. (2003) Invited Review Cutaneous paraneoplastic syndromes in dogs and cats: a review of the literature. Veterinary Dermatology, 14, S. 279-296.



